2. 海南省农作物分子育种重点实验室, 三亚, 572025
3. 海南省热带农业资源研究所, 三亚, 572025
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 5 篇 doi: 10.5376/gab.cn.2011.30.0005
收稿日期: 2010年12月22日 接受日期: 2011年01月25日 发表日期: 2011年01月30日
引用格式(中文):
赵立仕等,2011,苏云金芽孢杆菌S3299-1的cry1Ac31基因鉴定与表达,基因组学与应用生物学(online),Vol.30 No.5 pp.1026-1031 (doi: 10.5376/gab.cn.2011.30.0005)
引用格式(英文):
Zhao et al.,2011, Identification and expression of cry1Ac31 from Bacillus thuringiensis S3299-1, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), Vol.30 No.5 pp.1026-1031 (doi: 10.5376/gab.cn.2011.30.0005)
本研究对从海南岛吊罗山热带雨林的土壤样品中分离的一株Bt菌株S3299-1进行了特性鉴定和基因克隆。镜鉴观察表明,Bt菌株S3299-1在芽孢形成期能产生典型的对鳞翅目小菜蛾有毒性的菱形晶体伴孢蛋白。通过PCR-RFLP方法鉴定该菌株cry1A基因型与模式菌株HD73相似。用PCR方法从S3299-1克隆了完整的ORF全长为3 537 bp,编码1 178个氨基酸(GeneBank Accession No. GU446674),由Bt毒素命名系统命名为cry1Ac31。我们将全长基因连接到表达载体pQE30Xa构建了表达重组质粒pQE1Ac31,用化学转化方法将其转入到表达宿主大肠杆菌JM110及M15中,分别获得表达重组子pQE1Ac31JM和 pQE1Ac31M。SDS-PAGE电泳分析表明,cry1Ac31基因在大肠杆菌中异源表达约130 kD的蛋白。SDS-PAGE分析表明,表达的Cry1Ac31蛋白大小约为130 kD。生物测定结果表明, 异源表达的Cry1Ac31蛋白对小菜蛾的有很高的杀虫活性(LC50为2.204 ng/mL),但比野生型菌株的伴孢蛋白对小菜蛾的杀虫活性(LC50为1.504 ng/mL)及HD73的伴孢蛋白对小菜蛾的杀虫活(LC50为2.058 ng/mL)要低。
苏云金芽孢杆菌(Bacillus thuringiensis, 简称Bt)是一种在土壤中常见的芽孢杆菌,在形成芽孢同时产生伴孢晶体(parasporal crystal),这种伴孢晶体对多种昆虫有致死活性,大量报道表明,已经发现对鳞翅目(Lepidoptera)、双翅目(Diptera)、鞘翅目(Coleoptera)、膜翅目(Hymenoptera)、同翅目(Homoptera)、直翅目(Orthoptera)、虱目(Phthiraptera)或食毛目(Mallophaga)、蚤目(Siphonaptera)和螨类(Acari)等昆虫纲9个目以及吸虫和绦虫、动植物线虫、鞭毛虫、变形虫和草履虫等具有特异性的杀虫活性(Schnepf et al., 1998)。自1901年Bt首次被发现以来,Bt作为生物农药已经广泛地应用于农业生产,Bt对环境的友好和对人畜的安全,使得Bt越来越受到人们的重视和关注。迄今为止,国际上已克隆了520多个杀虫蛋白基因(Crickmore et al., 2010),其中,已有许多cry基因被广泛应用于高效广谱杀虫工程菌的构建(韩丽珍等, 2009)和抗虫转基因植物的研究。cry1Ac是成果应用于转基因棉花的重要Bt毒素基因,商业化的应用已经长达十余年的历史(李惠杨等, 2010),但是,随着转Cry1Ac作物的大规模连续种植,以棉铃虫为代表的鳞翅目昆虫对其已经产生了抗性。因此,寻找多样化的抗虫基因成为Bt研究的热点。
海南省热带农业资源研究所自2004开始全国范围内收集Bt菌株资源和杀虫基因克隆,建立了具有特色的Bt菌株库,并克隆了cry1Ac22 (Xie et al., 2010)、cry1Ac30、cry30Ea1、cry 30Ga2、cry40Da1、cry50Ba1、cryBa2和cry54Ba1等基因(Crickmore et al., 2010);Liu等(2010)对Bt Cry1Ac22杀虫蛋白在酿酒酵母中的表达和细胞定位进行了分析。Bt菌株S3299-1是从海南吊罗山原始热带雨林自然保护区收集的土样中分离出来的(张文飞等, 2009),该菌株对鳞翅目类昆虫小菜蛾具有很高的杀虫活性。本研究从Bt菌株S3299-1中鉴定和克隆杀虫晶体蛋白基因cry1Ac31,并在大肠杆菌中实现cry1Ac31基因表达,且生物测定表明Cry1Ac31蛋白对鳞翅目昆虫小菜蛾有较高的活性。Bt S3299-1菌株鉴定及cry1Ac31基因克隆表达和活性测定为构建新型杀虫工程菌以及抗虫转基因作物防治鳞翅目昆虫提供了菌株和基因资源。
1结果与分析
1.1 Bt S3299-1的伴胞晶体蛋白观察
Bt菌株S3299-1从采集的海南吊罗山自然保护区的土壤样品中分离分离获得(张文飞等, 2009)。在1/2 LB固体培养基30℃培养2 d其芽孢形成,挑取少量菌体用石碳酸复红染液染色,用光学显微镜镜观察,发现和模式菌株HD-73一样均产生菱形伴胞晶体(图1A; 图1B),扫描电镜观察证实Bt菌株S3299-1在芽孢形成期产生典型的菱形晶体蛋白(图1C)。
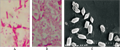 图1 Bt菌株S3299-1和HD73镜鉴的菌体形态和伴孢晶体 |
1.2 Bt S3299-1的伴胞晶体蛋白SDS-PAGE分析
Bt S3299-1菌株在芽孢形成期产生约为130 kD的杀虫晶体蛋白(图2),在用液体LB培养基,220 r/min,30℃培养,培养约32 h杀虫晶体蛋白开始形成,培养32~48 h该杀虫晶体蛋白浓度逐渐增加,随后杀虫晶体蛋白分泌进入稳定期。
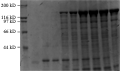 图2 Bt S3299-1菌株的伴胞晶体SDS-PAGE电泳图 |
1.3 cry基因的PCR-RFLP鉴定
本研究利用34对鉴定cry基因的通用引物对Bt菌株S3299-1进行了cry基因型鉴定,通用引物k5un2/k3un2产生相应的PCR产物(张文飞等, 2009)。菌株S3299-1和阳性参照菌株HD-73的PCR扩增产物均为1.6 kb,进一步利用用限制性内切酶XbaⅠ和PstⅠ消化PCR片段,进行RFLP分析,结果表明两者的酶切带型一致(图3),由此说明Bt菌株S3299-1与HD73具有相似的cry1A基因型。
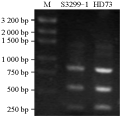 图3 Bt菌株S3299-1及HD73的PCR-RLFP鉴定 |
1.4 cry1Ac31基因的克隆
本实验以菌株3299-1的质粒DNA为模板,用PCR引物E1A5/E1A3扩增获得3.5 kb的目的片段,将其插入pMD18T Easy载体,获得重组子pCRY1Ac31 (图4),序列测定表明,该基因ORF全长为3 537 bp 编码1 178个氨基酸,其推定的分子量约为133.2 kD,等电点为5.03。该基因由Bt毒素命名委员会命名为cry1Ac31 (GeneBank: GU446674 ) (Crickmore et al., 1998)。
 图4 cry1Ac31基因PCR扩增及酶切分析 |
1.5 cry1Ac31基因在E. coli 表达
将cry1Ac31基因编码序列连接到表达载体pQE30xa中,获得表达重组质粒pQE1Ac31,用化学转化方法将其转入到表达宿主大肠杆菌JM110及M15中,分别获得表达重组子pQE1Ac31JM和pQE1Ac31M。利用IPTG进行诱导表达,SDS-PAGE电泳分析表明,cry1Ac31基因在大肠杆菌中异源表达约130 kD的蛋白(图5)。
 图5表达重组子pQE1Ac31JM和pQE1Ac31M的表达产物SDS-PAGE电泳图 |
1.6 二龄小菜蛾杀虫活性测定
把标定浓度蛋白浓度分别稀释到6 ng/mL、4 ng/mL、2.5 ng/mL、1.5 ng/mL、1 ng/mL和0.5 ng/mL六个浓度,分别用无菌水和HD73蛋白作为阴性对照和阳性对照,72 h后统计小菜蛾死亡情况。利用统计学软件SPSS.13进行毒性回归分析(表1),结果表明,野生型菌株S3299-1晶体蛋白对小菜蛾的杀虫活性LC50为1.504 ng/mL,明显高于标准菌株HD-73 (LC50为2.058 ng/mL)对小菜蛾的杀虫活性。在大肠中表达的Bt Cry1Ac31包含蛋白对小菜蛾的杀虫活性为LC50 2.204 ng/mL),与来自标准菌株HD-73及野生型菌株的晶体蛋白对小菜蛾的杀虫活性相比要稍低。
| 表1 cry1Ac31基因表达产物对小菜蛾二龄虫的毒性测定 |
2结论
Bt S3299-1菌株,分离自海南岛热带原始雨林的土壤中,其形态特性与Bt模式菌株HD-73相似。应用PCR-RFLP方法鉴定该菌株cry1A基因型与模式菌株HD73相似。用PCR方法从S3299-1克隆了完整的ORF全长为3 537 bp,编码1 178个氨基酸(GeneBank Accession GU446674),由Bt毒素命名系统命名为cry1Ac31。将cry1Ac31基因连接到表达载体pQE30Xa在大肠杆菌中异源表达,表达的Cry1Ac31蛋白大小约为130 kD。异源表达的Cry1Ac31包涵体的对小菜夜蛾的杀虫活性比野生型菌株以及HD73菌株在芽孢形成期产生的晶体蛋白的杀虫活性要稍低,这可能是异源表达的原因。野生型菌株的伴孢晶体蛋白对鳞翅目昆虫小菜夜蛾毒性比模式菌株HD-73明显要高,因此,Bt S3299-1菌株及其毒性编码基因cry1Ac31仍然不失为扩大和丰富Bt菌株及毒性基因多样性的候选菌株。
3材料与方法
3.1质粒与菌株
本实验的菌株与质粒列于表2,其中载体pMD18 T Easy 用来克隆PCR产物,载体pQE30xa用来表达cry1Ac31基因, E. coli JM110、M15作为其表达宿主细胞。
 表2 cry1Ac31基因表达产物对小菜蛾二龄虫的毒性测定 |
3.2培养基、抗生素与试剂
LB培养基用于Bt菌株和大肠杆菌培养,G Tris培养基用于促进Bt芽孢形成和伴胞晶体产生(Aronson and Thompson, 1971) SOC培养基用于电转化后的感受态细胞的复苏,TB液体培养基用于蛋白诱导表达培养。Bt菌株和大肠杆菌分别在30℃和37℃恒温培养。氨苄青霉素和卡那霉素使用浓度分别100 μg/mL和12.5 μg/mL根据需要加入培养基。PCR试剂购自大连宝生物工程有限公司,限制内切酶从MBI公司购买。
3.3伴胞晶体显微镜观察
Bt菌株伴胞晶体观察,按照Xie等(2010)的方法利用石碳酸对在芽孢期的细菌细胞进行染色,在光学油镜下进行观察。按照Zhang等(2010)的方法制备电镜观察样本,在扫描电子显微镜进行观察。
3.4菌株蛋白SDS-PAGE分析
Bt菌株S3299-1在200 mL的G-Tris培养基中培养48 h,12 000 r/min,4 ℃离心10 min收集菌体,溶于30 mL无菌水中,悬浮液超声波(800 w)处理10 min,用1 mol/L的NaCl洗涤3次,最后溶于10 mL Na2CO3 (浓度: 50 mmol/L; pH 10),SDS-PAGE (7.5%)电泳分析按照Liu等(2010)的方法进行。
3.5 Bt质粒提取和PCR-RLFP分析
Bt菌株HD-73、S3299-1质粒DNA提取参照Xie等(2010)的方法。用质粒DNA作为PCR模板,34对鉴定cry基因的通用引物对Bt菌株S3299-1进行cry基因型鉴定(谢柳等, 2009),目的PCR片段再进行限制内切酶消化,琼脂糖电泳进行鉴定。
3.6 cry1Ac31基因的克隆
根据引物E1A5/E1A3,即E1A5:CGGGATCCAGAG ATGGAGGTAACTTATG (BamHⅠ酶切位点),E1A3:ACGCGTCGACTGAGACTATTCCTCCATAAG (SalⅠ酶切位点),进行PCR目的基因PCR扩增(张文飞等, 2009)。用琼脂糖凝胶DNA回收试剂盒回收并纯化PCR产物。纯化的PCR产物与pMD18 T Easy载体连接,转入大肠杆菌JM110,利用引物k5un2/k3un2筛选阳性鉴定,k5un2:AGGACCAGGATTTACAGGAGG;k3un2:GCTGTGACACGAAGGATATAGCCAC,进一步用限制内切酶BamHⅠ和SalⅠ消化验证,获得含有目的PCR片段重组子pCRY1Ac31,由上海生物工程进行序列测定。
3.7 cry1Ac31基因在E. coli 表达
用限制性内切内酶BamHⅠ和SalⅠ于37℃水浴完全消化重组质粒pCRY1Ac31和载体pQE30xa,用0.8%的琼脂糖凝胶电泳限制内切酶消化产物,进行胶回收和纯化,利用T4连接酶将cry1Ac31基因全长序列和表达载体pQE30xa连接,转入表达宿主大肠杆菌M15,在含有氨苄青霉素(100 μg/mL)和卡那霉素(12.5 μg/mL)的LB培养基平板进行阳性重组子筛选,并用PCR的方法和酶切克隆子质粒验证,最终通过序列测定确定获得含cry1Ac31基因编码序列正确插入表达载体pQE30xa的重组子pQE1Ac31。重组子pQE1Ac31在含有氨苄青霉素和卡那霉素的的LB液体培养基37℃,230 r/min培养过夜活化,按1:100比例转入含有相应抗生素的TB培养基中37℃,230 r/min 培养至OD值0.6左右用异丙基-β-D-硫代半乳糖苷诱导(IPTG)至最终浓度为1 mmol/L于30℃,230 r/min培养,在IPTG诱导4 h和18 h分别取样制备蛋白,进行超声波破碎处理10 min,并用1 mol/L的NaCl洗涤3次,用IPTG诱导处理未插入基因片段的空载体pQE30xa作为参照,用7.5%胶进行SDS-PAGE电泳分析(Liu et al., 2010)。
3.8毒蛋白小菜夜蛾生物测定
采用浸叶法进行小菜夜蛾生物活性测定(谢柳等, 2009; 张文飞等, 2009; Crespo et al., 2008)以牛血清蛋白(BSA)作为标准利用,运用Lowry assay方法测定Bt菌株蛋白和大肠杆菌异源表达蛋白的浓度。把供试蛋白浓度分别稀释到6 ng/mL、4 ng/mL、2.5 ng/mL、1.5 ng/mL、1ng/mL、0.5 ng/mL六个浓度,分别用无菌水和HD73蛋白作为阴性对照和阳性对照,72 h后统计小菜蛾死亡情况。利用统计学软件SPSS.13进行毒性回归分析。供试害虫为实验室饲养的敏感种群二龄幼虫小菜蛾。取实验室种植的白菜,挑选鲜嫩一致白菜叶洗净晾干,将其浸入稀释好浓度的样品中10 s,然后晾干放入生测瓶中,每个生测瓶放入40供试害虫二龄虫小菜蛾,每个浓度3个重复。无菌水作为空白对照,放入25℃恒温光照培养箱,光照周期为12 h:12 h,相对湿度控制为65%,72 h后,观察幼虫的生长情况,利用SPSS软件进行概率回归分析获得LC50值。
作者贡献
赵立仕、李财新和田亮是本研究的实验研究执行人;谢柳和张文飞参与实验设计与试验结果分析;李有志参与了实验的指导、讨论、论文写作与修改,部分工作是在李有志实验室完成的;方宣钧是项目的负责人,指导实验设计,数据分析,论文修改和写作。全体作者都阅读并同意最终的文本。
致谢
本研究受中国Bt收集与鉴定项目的资助。作者十分感谢感谢海南省热带农业资源研究所养虫室提供小菜蛾生测服务。感谢两位匿名的同行评审人的评审建议和修改建议。本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
Aronson J.N., and Thompson F.M., 1971, Bacillus thuringiensis sporulation at suboptimal temperature, J . Bacteriol., 105: 445-448
Crespo A.L.B., Spencer T.A., Nekl E., Pusztai-Carey M., Moar W.J., and Siegfried B.D., 2008, Comparison and validation of methods to quantify Cry1Ab toxin from Bacillus thuringiensis for insect bioassays, Appl. Environ. Microbiol., 74(1): 130-135 doi:10.1128/AEM.01855-07 PMid: 17981939 PMCid: 2223200
Crickmore N., Zeigler D.R., Feitelson J., Schnepf E., van Rie J., Lereclus D., Baum J., and Dean DH., 1998, Revision of the nomenclature for the Bacillus thuringiensis pesticidal crystal proteins, Microbiol. Mol. Biol. Rev., 62(3): 807-813 PMid: 9729610 PMCid:98935
Crickmore et al., 2010, http://www.lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/index.htmL
Han L.Z., Liu C., Xie L., and Li Y.Z., 2009, Progress on vegetative insecticidal protein VIP3 of Bacillus thuringiensis, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(4): 779-785 (韩丽珍, 刘辰, 谢柳, 李有志, 2009, 苏云金芽孢杆菌营养期杀虫蛋白VIP3 研究进展, 基因组学与应用生物学, 28(4): 779-785)
Hire R.S., Makde R.D., Dongre T.K., and D’souza S.F., 2008, Charcterizatiom of the cry1Ac gene from an indigenous strain of Bacillus thuringiensis subsp. Kenyae, Curr. Microbiol., 57(6): 570-574 doi:10.1007/s00284-008-9244-3 PMid: 18795364
Li H.Y., Xie L., Xiong Q.M., Nong L.M., and Zhang W.F., 2010, Biological control of mosquitoes by Bacillus thuringiensis, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology) (online), Vol 29 No 4, DOI: 10.5376/gab.cn.2010.29.0009 (李惠杨, 谢柳, 熊绮梦, 农林美, 张文飞, 2010, Bt应用于蚊的生物防治, 基因组学与应用生物学(online), 第29卷, 第9篇, DOI: 10.5376/gab.cn.2010.29.0009)
Liu Z.M., Zhang W.F., Xie L., Li Y.Z., Liu S.K., and Fang X.J., 2010, Heterologous expression and purification of Cry1Ac22 toxin from Bacillus thuringiensis W015-1, Bt Research Vol.1, (submission provisional published)
Schnepf E., Crickmore N., van Rie J., Lereclus D., Baum J., Feitelson J., Zeigler D.R., and Dean D.H., 1998, Bacillus thuringiensis and its pesticidal crystal proteins, Microbiol and Molecular Biology Review, 62(3): 3775-3806
Xie L., Zhang W.F., Liu Z.M., Cai Y.G., Li Y.Z., and Fang X.J., 2010, Characterization of a new highly toxic isolate of Bacillus thuringiensis from the diapausing larvae of silkworm and identification of cry1A 22 gene, Bt Research (online), Vol.1, No.1 (DOI: 10.5376/bt.2010.01.0001)
Xie L., Zhang W.F., Quan J.X., Liu Z.M., Ye D.W., Li Y.Z., and Fang X.J., Bacillus thuringiensis collection and isolates identification from Damingshan and Dawangling Natural Reserves in Guangxi Province, 2009, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(1): 62-68 (谢柳, 张文飞, 全嘉新, 刘卓明, 叶大维, 李有志, 方宣钧, 2009, 广西大王岭和大明山自然保护区苏云金芽孢杆菌收集与鉴定, 基因组学与应用生物学, 28(1): 62-68)
Zhang W.F., Quan J.X., Xie L., Wang X., Yi Y.T., Feng M.M., Zhu L., Wang R.P., and Fang X.J., 2009, Collection of Bacillus and identification of Bacillus thuringiensis isolates from tropical rain forest reserves of Hainan island, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(2): 265-274 (张文飞, 全嘉新, 谢柳, 王茜, 易艳桃, 丰玫玫, 朱麟, 王锐萍, 方宣钧, 2009, 海南岛热带雨林区芽孢杆菌收集及 菌鉴定, 基因组学与应用生物学, 28(2): 265-274)